-
2024/05/02 07:10

LTN經濟通》習近平政績?中國窮鬼套餐盛行
-
2024/05/02 18:05

「熊貓超市」停業?foodpanda證實:5月底前終止服務
-
2024/05/02 14:12

台積電熊本廠薪水「打壞行情」 日企無奈:給到極限也找嘸人
-
2024/05/02 15:22

「液體黃金」橄欖油飆天價 分析師直呼從業以來首見
-
2024/05/02 14:45

中鋼董座翁朝棟申請退休獲准 總經理王錫欽暫代
-
2024/05/02 11:20

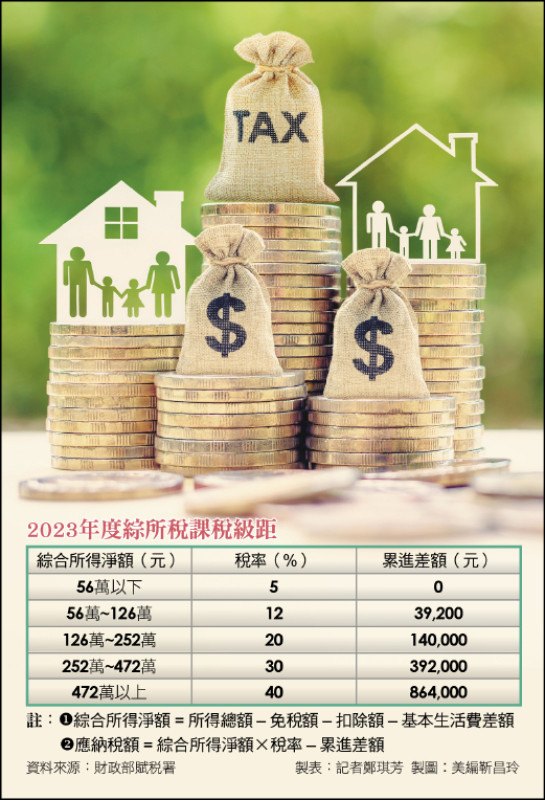
報稅季起跑!綜所稅申報攻略一次看
-
2024/05/02 06:56

熱門概念股》資產股

高鐵公司獲證交所「公司治理評鑑」佳績 連7年排名前5%

國際珍珠奶茶日 瑪利亞心智障礙青年推珍奶襪

穆迪維持台灣主權評等為Aa3 肯定央行貨幣政策表現

高淨值家族取代壽險 成商用不動產大買家

高雄和發園區推員工識別證減碳方案 首波25家企業響應

防遊戲成癮!網銀宣布斥資千萬致力推動「責任遊戲」

國喬總座曾嘉雄兼任永續長 預計2030年減碳45%

首屆「華航馬拉松」星光夜跑10 /12 開跑 祭出獎金上百萬

綠學院觀點》【綠色人才領航地圖三】具備這三個能力,你可以敲1,800家企業的門

綠學院觀點》【綠色人才領航地圖二】入行捷徑!永續顧問|低碳解決方案服務商釋出超過2,000個工作

一銀統籌主辦怡和國際31億元聯貸案 超額認貸155%

熱門概念股》水資源概念股

《財富自由Talk》專訪第一金投信董事長尤昭文︰ETF紅透半邊天 專家教你怎麼買

《財富自由Talk》專訪第一金投信董事長尤昭文︰ETF紅透半邊天 專家教你怎麼買

《財富自由Talk》專訪投信投顧公會理事長劉宗聖︰給年輕人、退休族的投資理財建議

《財富自由Talk》專訪投信投顧公會理事長劉宗聖︰給年輕人、退休族的投資理財建議

CEO開講》許棋凱:結合台大資源 落實社區照護

CEO開講》沈伯洋:台灣人 須有抗敵意識

CEO開講》吳彥宏:台灣若遇重大災變 是方確保7天不斷網

《焦點人物》李孟諺深入剖析行政院打炒房政策

《焦點人物》獨家披露 - 李孟諺近身觀察三位行政院長

達人理財秘訣》羅尤美:美國債信被降 這產品最能避險

首長早餐會》翁章梁:嘉義農產品 要賣向全世界

博士開講》吳再益:台積電是用電巨獸 電力開發須加快
股市跑馬燈
06:50:46仁新
代重要子公司Belite Bio, Inc公告完成現金增資06:41:03謚源
公告113年第一季財務報告董事會召開日期06:28:33藥華藥
本公司長效型顆粒性白血球生成素P2203之第一期臨床試驗案 (IND)已獲衛生福利部原則同意試驗進行05:05:33健喬
公告本公司擬召開董事會審議113年第一季合併財務報告22:43:33美而快
公告本公司113年第1季財務報告董事會召開日期22:24:07國際中橡
公告本公司113年第一季財務報告董事會召開日期22:22:27鎰勝
公告本公司113年第一季合併財務報告提請董事會決議之召開日期22:20:09霈方
公告本公司113年第一季合併財務報告董事會召開日期22:19:56大宇
公告本公司配合檢調單位執行搜索調查事宜22:09:23富邦媒
公告本公司董事會決議資本公積轉增資發行新股本資料由 (興櫃公司) 6696 仁新 公司提供
| 序號 | 1 | 發言日期 | 113/05/03 | 發言時間 | 06:50:46 |
|---|---|---|---|---|---|
| 發言人 | 王正琪 | 發言人職稱 | 總經理暨研發長 | 發言人電話 | 02-87805008 |
| 符合條款 | 第 44 款 | 事實發生日 | 113/05/03 | ||
| 說明 |
1.事實發生日:113/05/03 |
||||
以上資料均由各公司依發言當時所屬市場別之規定申報後,由本系統對外公佈,資料如有虛偽不實,均由該公司負責。
本資料由 (上櫃公司) 2235 謚源 公司提供
| 序號 | 1 | 發言日期 | 113/05/03 | 發言時間 | 06:41:03 |
|---|---|---|---|---|---|
| 發言人 | 王妤暄 | 發言人職稱 | 發言人 | 發言人電話 | (03)3973868 |
| 符合條款 | 第 31 款 | 事實發生日 | 113/05/02 | ||
| 說明 |
1.董事會召集通知日:113/05/02 |
||||
以上資料均由各公司依發言當時所屬市場別之規定申報後,由本系統對外公佈,資料如有虛偽不實,均由該公司負責。
本資料由 (上市公司) 6446 藥華藥 公司提供
| 序號 | 1 | 發言日期 | 113/05/03 | 發言時間 | 06:28:33 |
|---|---|---|---|---|---|
| 發言人 | 林國鐘 | 發言人職稱 | 執行長 | 發言人電話 | (02)26557688 |
| 符合條款 | 第 10 款 | 事實發生日 | 113/05/02 | ||
| 說明 |
1.事實發生日:113/05/02 |
||||
以上資料均由各公司依發言當時所屬市場別之規定申報後,由本系統對外公佈,資料如有虛偽不實,均由該公司負責。
本資料由 (上櫃公司) 4114 健喬 公司提供
| 序號 | 1 | 發言日期 | 113/05/03 | 發言時間 | 05:05:33 |
|---|---|---|---|---|---|
| 發言人 | 暫缺待補 | 發言人職稱 | 暫缺待補 | 發言人電話 | (02)8797-7100 |
| 符合條款 | 第 31 款 | 事實發生日 | 113/05/02 | ||
| 說明 |
1.董事會召集通知日:113/05/02 |
||||
以上資料均由各公司依發言當時所屬市場別之規定申報後,由本系統對外公佈,資料如有虛偽不實,均由該公司負責。
本資料由 (上櫃公司) 5321 美而快 公司提供
| 序號 | 1 | 發言日期 | 113/05/02 | 發言時間 | 22:43:33 |
|---|---|---|---|---|---|
| 發言人 | 王志仁 | 發言人職稱 | 總經理 | 發言人電話 | 0939390157 |
| 符合條款 | 第 31 款 | 事實發生日 | 113/05/02 | ||
| 說明 |
1.董事會召集通知日:113/05/02 |
||||
以上資料均由各公司依發言當時所屬市場別之規定申報後,由本系統對外公佈,資料如有虛偽不實,均由該公司負責。
本資料由 (上市公司) 2104 國際中橡 公司提供
| 序號 | 1 | 發言日期 | 113/05/02 | 發言時間 | 22:24:07 |
|---|---|---|---|---|---|
| 發言人 | 李超儒 | 發言人職稱 | 策略長 | 發言人電話 | 02-25316556 |
| 符合條款 | 第 31 款 | 事實發生日 | 113/05/02 | ||
| 說明 |
1.董事會召集通知日:113/05/02 |
||||
以上資料均由各公司依發言當時所屬市場別之規定申報後,由本系統對外公佈,資料如有虛偽不實,均由該公司負責。
本資料由 (上市公司) 6115 鎰勝 公司提供
| 序號 | 1 | 發言日期 | 113/05/02 | 發言時間 | 22:22:27 |
|---|---|---|---|---|---|
| 發言人 | 高事榮 | 發言人職稱 | 協理 | 發言人電話 | 03-3282391 |
| 符合條款 | 第 31 款 | 事實發生日 | 113/05/02 | ||
| 說明 |
1.董事會召集通知日:113/05/02 |
||||
以上資料均由各公司依發言當時所屬市場別之規定申報後,由本系統對外公佈,資料如有虛偽不實,均由該公司負責。
本資料由 (上櫃公司) 6574 霈方 公司提供
| 序號 | 4 | 發言日期 | 113/05/02 | 發言時間 | 22:20:09 |
|---|---|---|---|---|---|
| 發言人 | 呂慶盛 | 發言人職稱 | 董事長 | 發言人電話 | 02-2775-5566 |
| 符合條款 | 第 31 款 | 事實發生日 | 113/05/02 | ||
| 說明 |
1.董事會召集通知日:113/05/02 |
||||
以上資料均由各公司依發言當時所屬市場別之規定申報後,由本系統對外公佈,資料如有虛偽不實,均由該公司負責。
本資料由 (上市公司) 1445 大宇 公司提供
| 序號 | 2 | 發言日期 | 113/05/02 | 發言時間 | 22:19:56 |
|---|---|---|---|---|---|
| 發言人 | 楊任凱 | 發言人職稱 | 總經理 | 發言人電話 | 2552-3977 |
| 符合條款 | 第 19 款 | 事實發生日 | 113/05/02 | ||
| 說明 |
1.事實發生日:113/05/02 |
||||
以上資料均由各公司依發言當時所屬市場別之規定申報後,由本系統對外公佈,資料如有虛偽不實,均由該公司負責。
本資料由 (上市公司) 8454 富邦媒 公司提供
| 序號 | 7 | 發言日期 | 113/05/02 | 發言時間 | 22:09:23 |
|---|---|---|---|---|---|
| 發言人 | 谷元宏 | 發言人職稱 | 總經理 | 發言人電話 | (02)2162-6688 |
| 符合條款 | 第 11 款 | 事實發生日 | 113/05/02 | ||
| 說明 |
1.董事會決議日期:113/05/02 |
||||
以上資料均由各公司依發言當時所屬市場別之規定申報後,由本系統對外公佈,資料如有虛偽不實,均由該公司負責。